Les percées les plus récentes dans la recherche et le traitement du cancer ont eu lieu dans le domaine de l’immuno-oncologie, en utilisant de nouvelles immunothérapies pour renforcer le système immunitaire de l’hôte afin de cibler et de détruire plus efficacement les cellules tumorales. Parmi la liste des traitements approuvés par la FDA ayant une activité immunorégulatrice figurent les immunothérapies à base d’anticorps et de cytokines, les médicaments à petites molécules et la thérapie cellulaire. Le succès de ces thérapies et d’autres pour prolonger la survie a mis l’accent sur la mise au point de nouvelles thérapies à agent unique et combinées plus efficaces dans le traitement du cancer.
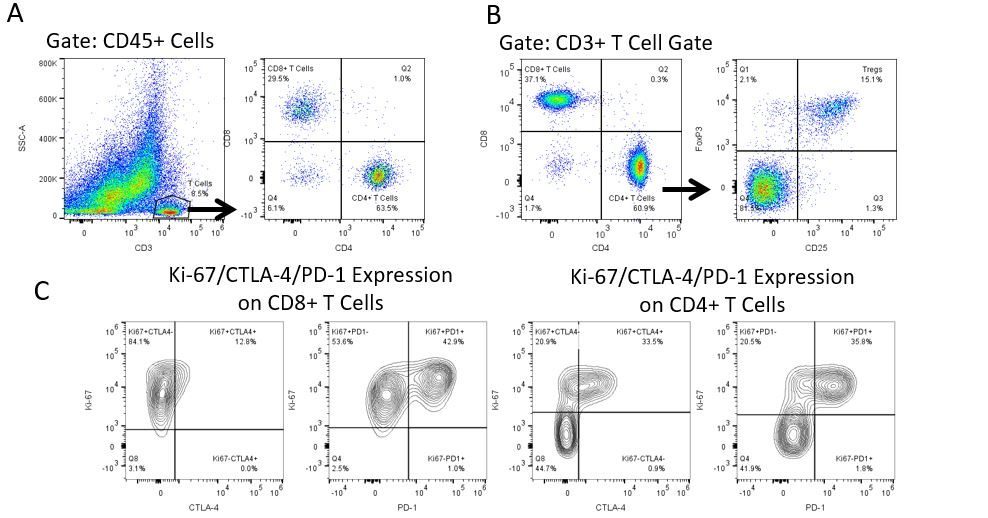
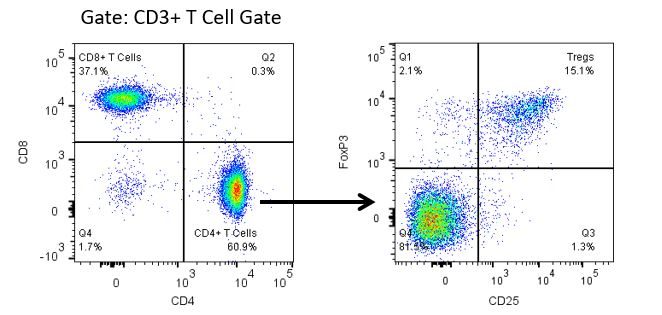
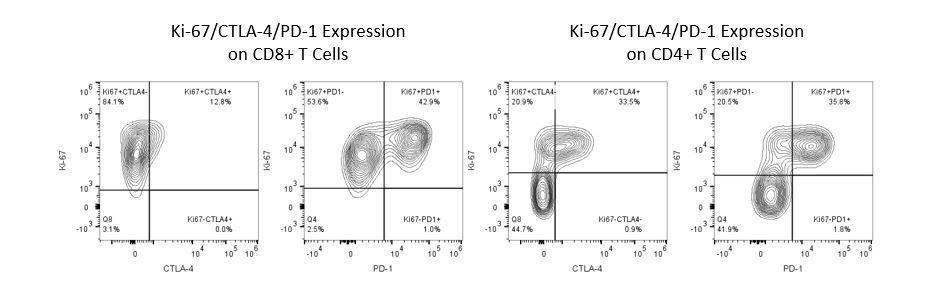
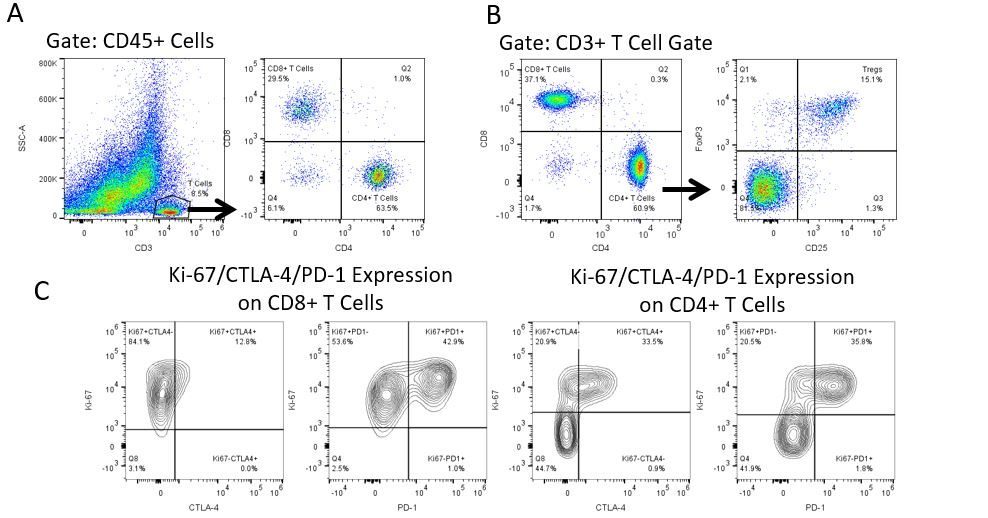
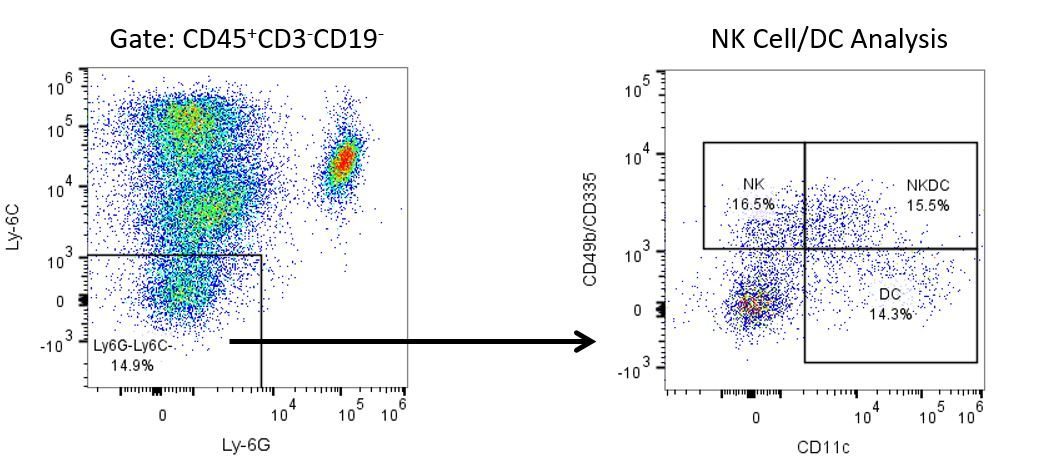
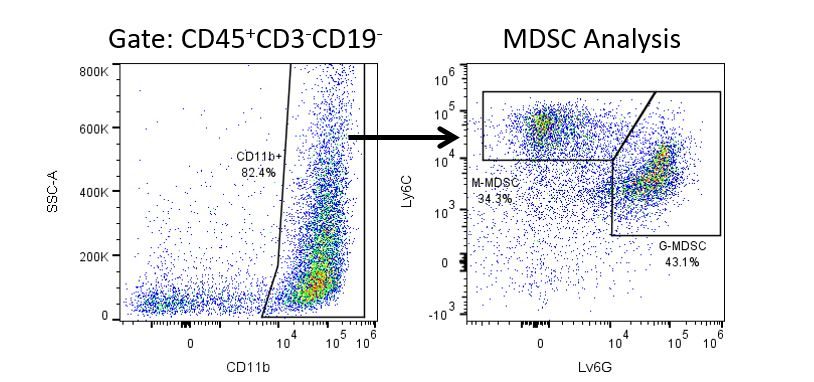
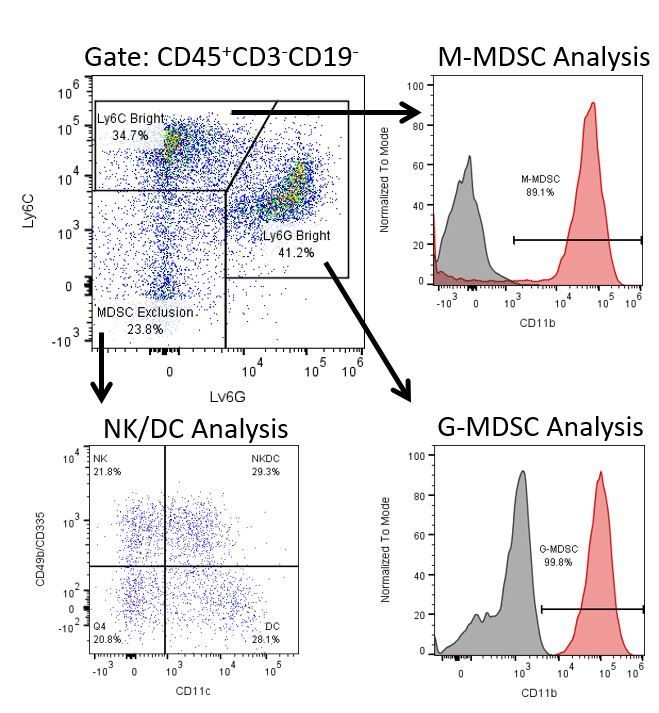
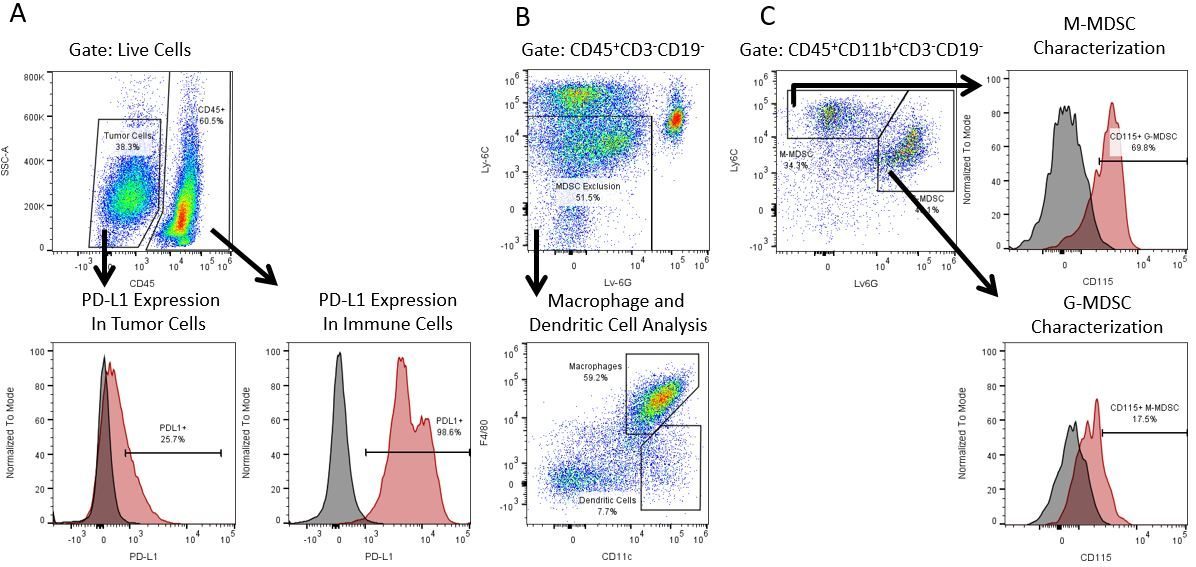
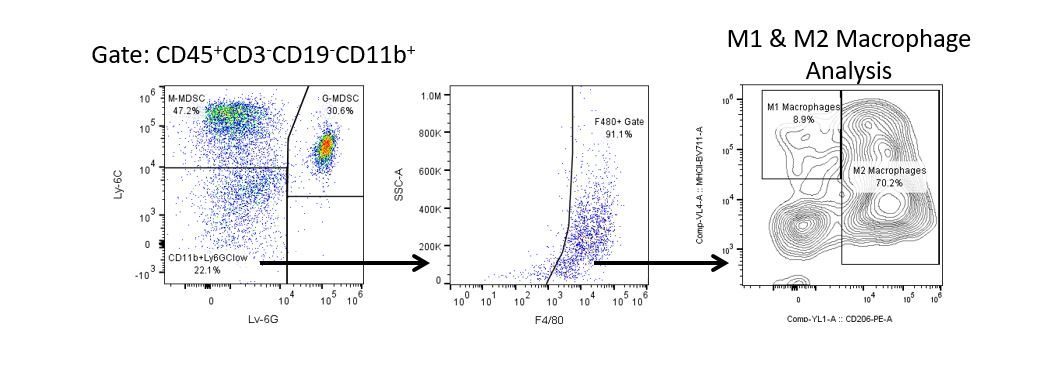
Le développement productif d’immunothérapies nécessite une analyse quantitative robuste et à haut débit du système immunitaire dans le microenvironnement tumoral, le sang périphérique et d’autres tissus de l’hôte.
Pour répondre à ce besoin, notre service de cytométrie en flux contractuel vous fournit une ressource de cytométrie en flux analytique avancée et à la pointe de la technologie pour répondre à tous les aspects de vos besoins en matière de développement de médicaments. Exécutez vos études de génération d’échantillons avec nous ou envoyez-nous par envoi express vos échantillons précliniques ou cliniques non régis par la CLIA et nous nous occuperons de la cytométrie en flux pour vous.